Bestimmung der Konzentration an gelöstem Kohlendioxid in karbonisierten Getränken mittels Titrimetrie (Maßanalyse)
Geeignet zur Bestimmung der Konzentration an gelöstem Kohlendioxid in karbonisierten Getränken. Konzentrationsbereich 0 bis 8,4 g/l
Durch Zusatz von Natronlauge wird das Kohlendioxid des Getränkes als Natriumhydrogencarbonat bzw. Natriumcarbonat gebunden. Aus einem aliquoten Teil des mit Natronlauge versetzten Getränkes wird durch Zusatz von Schwefelsäure das Kohlendioxid wieder freigesetzt und durch einen Luftstrom in Bariumhydroxidlösung geleitet. Durch Rücktitration des nicht verbrauchten Bariumhydroxids kann der Kohlendioxidgehalt des Getränkes bestimmt werden [1].
Malz, das für die Verwendung in der Brau- und Lebensmittelindustrie vorgesehen ist.
Einer gepufferten Stärkelösung wird der aliquote Teil eines Malzauszuges zugesetzt und genau 30 min bei 20 °C temperiert. Dann wird iodometrisch die hauptsächlich durch die Tätigkeit der β-Amylase aus der Stärkelösung gebildeten Maltose nach folgender Reaktionsgleichung bestimmt:
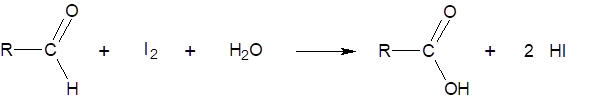
Die Methode beschreibt die Bestimmung des Gehalts an freiem Chlor und Gesamtchlor mittels der tritrimetrischen Methode mit DPD.
Reaktion mit N,N-Diethyl-1,4-phenylendiamin (DPD) unter Bildung einer rot gefärbten Verbindung bei pH 6,2−6,5. Titration mit einer Ammoniumeisen (II)-sulfat-Standardlösung bis zum Verschwinden der roten Färbung. Gesamtchlor wird unter einem Überschuss an Kaliumiodid gemessen.
Die Methode beschreibt die Bestimmung von Chlordioxid in Wasser mittels des titrimetrischen Verfahrens.
Wasser, das in der Brau- und Lebensmittelindustrie verwendet wird.
Reaktion mit N,N-Diethyl-1,4-phenylendiamin (DPD) unter Bildung einer rot gefärbten Verbindung bei pH 6,2–6,5. Hierbei wird Chlordioxid zum Chlorit-Ion reduziert. Titration mit einer Ammoniumeisen(II)-sulfat-Lösung bis zum Verschwinden der roten Färbung. Aus dem Verbrauch der Ammoniumeisen(II)-sulfat-Lösung wird die Konzentration an Chlordioxid in der Wasserprobe errechnet. Die Bildung des roten Farbstoffes aus DPD erfolgt nicht nur in Gegenwart von Chlordioxid. Je nach Redox-Spannung und Konzentration wird die Oxidation von allen oxidierenden Stoffen bewirkt.
Bestimmung der Konzentration von alkalischen Reinigern an Branntkalk (CaO) und Natriumhydroxid (NaOH) ohne Soda (Na2CO3).
Bestimmung des Gehalts an Branntkalk (CaO) oder Natriumhydroxid (NaOH) der Reinigerlösung mit einer Säurelösung (HCl oder H2SO4) mit entsprechender Normalität bis zum Farbumschlag von Phenolphthalein (pH 8,2).
Branntkalk
|
CaO + H2O |
→ Ca(OH)2 |
|
|
Ca(OH)2 + 2 HCl |
→ CaCl2 + H2O |
farblos gegen Phenolphthalein |
|
Ca(OH)2 + H2SO4 |
→ CaSO4 + 2 H2O |
farblos gegen Phenolphthalein |
Natriumhydroxid
|
NaOH + HCl |
→ NaCl + H2O |
farblos gegen Phenolphthalein |
|
2 NaOH + H2SO4 |
→ Na2SO4 + 2 H2O |
farblos gegen Phenolphthalein |
Bestimmung der Konzentration von alkalischen Reinigern an Natriumhydroxid (NaOH) und Soda (Na2CO3).
Alle alkalischen Reinigungslösungen oder "Stapellösungen" die neben Natriumhydroxid (NaOH) als Reinigungskomponente auch Soda (Na2CO3) enthalten.
Ist mit einer stärkeren Beeinflussung der Lauge durch Kohlensäure zu rechnen oder werden die Reinigungslösungen über einen längeren Zeitraum verwendet (,Stapelreinigung‘), so ist zur exakten Ermittlung der Konzentration oder des pH-Wertes der Karbonisierungsgrad zu berücksichtigen, da die entstandene Soda stark verminderte Reinigungswirkung besitzt, aber eine zu hohe Konzentration des aktiven Reinigungsmittels vortäuscht.
Bestimmung des Gehalts an Natriumhydroxid (NaOH) der Reinigerlösung mit einer Säurelösung (HCl oder H2SO4) mit entsprechender Normalität bis zum Farbumschlag von Phenolphthalein (pH 8,2).
NaOH + HCl → NaCl + H2O farblos gegen Phenolphthalein
2 NaOH + H2SO4 → Na2SO4 + 2 H2O
Bestimmung des Gehalts an Soda (Na2CO3) der Reinigerlösung mit einer Säurelösung (HCl oder H2SO4) mit entsprechender Normalität bis zum Farbunschlag von Methylorange (pH 4,3).
Na2CO3 + HCl → NaHCO3 + NaCl
NaHCO3 + HCl → NaCl + H2O + CO2 gelblichbraun gegen Methylorange
2 Na2CO3 + H2SO4 → 2 NaHCO3 + Na2SO4
2 NaHCO3 + H2SO4 → 2 Na2SO4 + H2O + 2 CO2