In der Methode werden die Geräte aufgeführt, die in einem mikrobiologischen Brauereilabor von Bedeutung sind.
Mikrobiologische Labore in der Brau- und Getränkeindustrie sowie deren Zulieferbetrieben.
Membranfiltrationseinheit inkl. Vakuumpumpe und Saugfilterflasche
Die Membranfiltration dient zur mikrobiologischen Untersuchung von filtrierbaren Flüssigkeiten. Hierbei werden Mikroorganismen durch eine sterile Filtermembran mit einer Porengröße von 0,45 µm oder 0,2 µm zurückgehalten. Die Membranfilter werden dann auf Nährmedien für anaerobe oder aerobe Mikroorganismen überführt und bebrütet.
Membranfiltrationseinheiten können aus einzelnen Filtertrichtern oder aus Filtrationsleisten mit mehreren Filtertrichtern bestehen.
|
Abb. 1: Membranfitrationseinheit bestehend aus Edelstahltrichter, Fritte und Woulff´scher Flasche |
Abb. 2: Membranfiltrationsleiste zur Verarbeitung mehrerer Proben |
 |
 |
Unterschiede bestehen vor allen in der Art der verwendeten Trichter. Klassischerweise werden Trichter aus Edelstahl verwendet, die vor Benutzung mittels Bunsenbrenner oder Autoklav sterilisiert werden. Alternativ werden aber häufig auch mehrmals verwendbare Kunststofftrichter eingesetzt, die im Autoklav sterilisiert werden können, oder sterile Einweg-Filtertrichter, bei denen Sterilisationsmaßnahem dann ganz entfallen.
Die Platzierung einer Membranfilterstation kann offen im Labor erfolgen, sofern die Filterdeckel den Trichter fest abschließen. Im Fall von Kunststofftrichtern sind nicht immer passende oder fest abschließende Deckel verfügbar, so dass in diesem Fall eine Filtration in der Sterilwerkbank zu empfehlen ist. Das Ansaugen von evtl. kontaminierter Fremdluft wird somit vermieden.
Anaerobentöpfe/Anaerobensysteme
Zur Kultivierung von anaeroben Mikroorganismen werden Anaerobentöpfe verwendet. Voraussetzung ist, dass die Behälter sich gasdicht verschließen lassen und keinen Sauerstoffzutritt erlauben.
Die Erzeugung der anaeroben Atmosphäre kann auf unterschiedlichem Weg erfolgen:
der Behälter wird mittels Vakuum evakuiert und anschließend mit einem sauerstofffreien Gasgemisch gespült
die Behälter werden mit Reaktionspäckchen gefüllt, welche den Luftsauerstoff im Behälter entfernen bzw. eine CO2-Atmosphäre erzeugen. Je nach Hersteller sind hier unterschiedliche Systeme verfügbar
Die Anaerobentöpfe, die mit Gas gespült werden, sind am Deckel mit zwei Ventilen versehen, die zum Spülen bzw. evakuieren vorgesehen sind. Eine Druckanzeige am Deckel misst den im Topf vorhandenen Druck
Einfacher im Aufbau sind die Anaerobentöpfe ohne Gasspülung, da diese lediglich dicht verschließbar sein müssen.
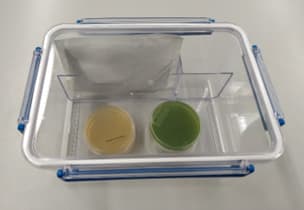
Abb. 3: Anaerobentopf zur Bebrütung anaerober Keime mittels sauerstoffzehrender Chemikalien
Anaerobentöpfe gibt es aus Metall, Kunststoff und Glas, wobei die Glas- und Kunststoffbehälter den Vorteil besitzen, dass man den Inhalt des Topfes ohne Öffnen des Deckels von außen begutachten kann und man somit z. B. einen Indikatorumschlag des Nährbodens erkennen kann.
Koloniezählgeräte [1]
Zum Auszählen von Kolonien auf oder in einer Agarplatte legt man transparente Agarplatten mit der Unterseite nach oben auf eine ruhige, neutrale Unterlage. Wichtig ist eine gleichmäßige blendfreie Beleuchtung der Agarplatte bzw. ihres Hintergrundes. Zweckmäßig ist auch die Verwendung einer Lupe mit 3-8facher Vergrößerung oder eines Stereomikroskops, damit man auch sehr kleine Kolonien noch erfassen kann. Die gezählten Kolonien markiert man in der Regel mit einem Farbstift auf der Unterseite der Petrischale, bei undurchsichtigen Nährböden auf dem Deckel.
Fortgeschrittener ist die Zählung mittels eines Koloniezählgeräts im Handheld Format. Hier wird mittels einer Schreibspitze die Kolonie gezählt, während das Ergebnis im LCD-Display dokumentiert wird.
Noch komfortabler und sicherer zählt man mit einem halbautomatischen oder automatischen Koloniezählgerät.
Koloniezählgeräte bieten, wenn auch nicht alle, drei verschiedene Möglichkeiten der Zählung:
Zählung durch Druck:
Bei dieser gebräuchlichsten Methode berührt man die (geschlossene) Petrischale über der zu zählenden Kolonie leicht mit einem Farbstift. Dabei wird die Kolonie markiert und zugleich die Petrischale etwas niedergedrückt; der Druck überträgt sich auf eine hochempfindliche Druckplatte und diese löst den Zählimpuls aus.
Zählen aufgrund elektrischer Leitfähigkeit:
Die Petrischale ist beim Zählvorgang geöffnet. Beim Einstich einer nadelförmigen Elektrode in eine Kolonie fließt ein Strom durch den leitfähigen Nährboden zu einer am Rand der Petrischale in den Agar gesteckten Gegenelektrode und löst den Zählvorgang aus. Das Verfahren ist für (möglicherweise) pathogene Mikroorganismen ungeeignet und wegen der Kontaminationsgefahr auch sonst nicht zu empfehlen.
Zählen von Hand:
Zählen auf herkömmliche Weise, indem manuell ein im Gerät vorhandener Druckschalter betätigt wird.
Zellzählung mittels Zählkammern [1]
Die gebräuchlichste Methode zur Bestimmung der Gesamtzellzahl bei relativ hoher Zellkonzentration, z. B. Reinzuchthefe, ist die direkte mikroskopische Auszählung der in einer Zählkammer verteilten Zellen. Die Methode ist schnell durchzuführen und erfordert geringen apparativen Aufwand.
Das Zählkammerverfahren setzt voraus, dass die Zellkonzentration relativ hoch ist (> 107 Zellen/ml). Außerdem müssen die Zellen homogen verteilt, unbeweglich oder immobilisiert sein und sie dürfen nicht zu klein sein, damit sie unter dem Mikroskop noch sicher zu erkennen sind.
Die Zählkammer ist eine dicke, plangeschliffene Glasplatte von Objektträgergröße, in deren Mitte quer zur Längsrichtung drei parallele Stege eingeschliffen sind, die durch Rinnen getrennt und begrenzt werden (Abb. 5).

Abb. 4: Zählkammer nach Thoma
Quelle: https://de.wikipedia.org/wiki/Z%C3%A4hlkammer#/media/Datei:Neubauer_improved_counting_chamber.jpg (aufgerufen am 17.11.2024)
Lizenz: https://commons.wikimedia.org/wiki/File:Neubauer_improved_counting_chamber.jpg?uselang=de#Lizenz (aufgerufen am 17.11.2024)
Die Oberfläche des mittleren, breiteren Steges liegt um einen geringen, genau definierten Betrag tiefer als die Oberfläche der beiden seitlichen Stege. Legt man ein plangeschliffenes, nicht zu dünnes Deckglas über die drei Stege, so ruht es nur auf den Seitenstegen, während über dem Mittelsteg ein seitlich offener Hohlraum (eine „Kammer“) entsteht, der eine bestimmte Tiefe aufweist.
In den mittleren Steg sind hochpräzis zwei durch eine Querrinne getrennte quadratische Liniennetze eingraviert. Die Netzquadrate haben eine definierte Kantenlänge und somit eine definierte Fläche, wodurch der Raum über dem Quadrat bei bekannter Höhe ein genau bestimmtes Volumen besitzt. Füllt man diesen Raum mit einer Mikroorganismensuspension und zählt unter dem Mikroskop die in ihm enthaltenen Zellen aus, so lässt sich die Zellzahl pro Milliliter berechnen.
Für die Zählung von Bakterien verwendet man in der Regel Zählkammern mit einer Tiefe von 0,02 mm, für die Zählung größerer Mikroorganismen wie Hefen, Kammern mit einer Tiefe von 0,1 mm.
Der Zählbereich besteht aus 16 Großquadraten, wobei die Großquadrate durch Kleinquadratreihen mit einer zusätzlichen Zwischenlinie begrenzt bzw. abgetrennt sind. Es gibt unterschiedliche Versionen der Thomakammer; hier dargestellt ist die weit verbreitete Version Neubauer alt bestehend aus 16 Großquadraten. Die Version Neubauer improved besteht aus 25 Großquadraten.
Abb. 5: Gesamtansicht des Zählbereichs einer Thomakammer (Version Neubauer alt)
Quelle: https://de.wikipedia.org/wiki/Z%C3%A4hlkammer#Z%C3%A4hlkammer_nach_Neubauer (abgerufen am 19.10.2024)
Lizenz: https://commons.wikimedia.org/wiki/File:Neubauer_classic_center_square.gif?uselang=de#Lizenz (abgerufen am 19.10.2024)
Die Zellzahl pro ml unverdünnter Mikroorganismensuspension berechnet sich nach folgender Formel:

Mit der Membranfiltration lassen sich auf einfache Art und Weise Mikroorganismen aus einem flüssigen Medium anreichern.
Quantitative Anreicherung von großen, filtrierbaren Volumina auf NBB-Agarplatten.
Membranfiltration auf Nährböden.
Ausschluss von Kontaminationen (indirekte, potenzielle und obligate Bierschädlinge) im Kaltwürzebereich.
Anstellwürze mit Reinzuchthefe.
Bei allen brauereimikrobiologischen Untersuchungen wird insbesondere der Nachweis von obligaten Bierschädlingen, aber auch von potenziellen Bierschädlingen, die zum Verderb des Getränks führen können, angestrebt.
Untersuchung von Würze auf bierschädliche Bakterien (anaerob mit Reinzuchthefe und Anreicherung).
Ausschluss von Kontaminationen (indirekte, potenzielle und obligate Bierschädlinge) im Kaltwürzebereich.
Anstellwürze ohne Reinzuchthefe.
Bei allen brauerei-mikrobiologischen Untersuchungen wird insbesondere der Nachweis von obligaten Bierschädlingen, aber auch von potenziellen Bierschädlingen, die zum Verderb des Getränks führen können, angestrebt.
Bei Würzeproben ohne Reinzuchthefe erfolgt eine mikroskopische Kontrolle (sowie Überprüfung auf Würzebakteriengeruch). Es wird mikroskopisch im Dunkelfeld auf bierschädliche Bakterien, wilde Hefen sowie eventuell vorhandene Würzebakterien untersucht.
Hefehaltige Prozessproben
Anaerobe Kultivierung, Mikroskopieren der Probe im Dunkelfeld
Hefehaltige Prozessproben
Anaerobe Kultivierung, Mikroskopieren der Probe im Dunkelfeld.