Bestimmung von Coffein und Theobromin mittels HPLC
Geeignet für coffeinaltige Getränke, Teegetränke und AFG
Coffein und Theobromin werden mittels HPLC an Umkehrphasen getrennt und mit einem UV-Detektor bestimmt
Bestimmung von Glucose und Fructose mittels Enzymatik
Glucose und Fructose werden durch das Enzym Hexokinase (HK) und Adenosin-5’-triphosphat (ATP) zu Glucose-6-phosphat (G-6-P) und Fructose-6-phosphat (F-6-P) phosphoryliert:
Glucose + ATP \(^{\underrightarrow{HK}}\) G-6-P + ADP
Fructose + ATP \(^{\underrightarrow{HK}}\) F-6-P + ADP
In Gegenwart des Enzymes Glucose-6-Phosphat-Dehydrogenase (G6P-DH) wird G-6-P von Nicotinamid-Adenin-Dinucleotidphosphat (NADP) zu Gluconat-6-phosphat oxidiert. Es entsteht reduziertes Nicotinamid-Adenin- Dinucleotidphosphat (NADPH):
\(\text{G-6-P}\hspace{0.2em}+\hspace{0.2em}\text{NADP}\hspace{0.8em}^{\underrightarrow{\text{G6P–DH}}}\hspace{0.8em} \text{Glucanat-6-Phosphat} + \text{NADP}+\text{H}^+\)
Die während der Reaktion gebildete NADPH-Menge ist der Glucosemenge äquivalent. NADPH ist Messgröße und wird aufgrund seiner Absorption bei 334, 340 oder 365 nm bestimmt.
Nach Ablauf der Reaktion wird F-6-P durch Phosphoglucose-Isomerase (PGI) in G-6-P überführt:
F-6-P \(^{\underrightarrow{PGI}}\) G-6-P
G-6-P reagiert wiederum mit NADP unter Bildung von Gluconat-6-Phosphat und NADPH. Die zusätzlich gebildete NADPH-Menge ist der Fructosemenge äquivalent und wird aufgrund seiner Absorption bei 334, 340 oder 365 nm photometrisch bestimmt.
Bestimmung von Glucose, Fructose, Saccharose mittels Enzymatik
Geeignet für Würze, Bier, Malzgetränke, Nährbier, Biermischgetränke, AFG, Säfte und Getränke
Der D-Glucosegehalt wird vor und nach enzymatischer Hydrolyse der Saccharose bestimmt. D-Fructose wird im Anschluss an die D-Glucose-Bestimmung gemessen.
D-Glucose-Bestimmung vor Invesion:
Glucose wird durch das Enzym Hexokinase (HK) und Adenosin-5’-triphosphat (ATP) zu Glucose-6-phosphat (G-6-P) phosphoryliert:

In Gegenwart des Enzymes Glucose-6-Phosphat-Dehydrogenase (G6P-DH) wird G-6-P von Nicotinamid-Adenin-Dinucleotidphosphat (NADP) zu Gluconat-6-phosphat oxidiert. Es entsteht reduziertes Nicotinamid-Adenin-Dinucleotidphosphat (NADPH):

Die während der Reaktion gebildete NADPH-Menge ist der Glucosemenge äquivalent. NADPH ist Messgröße und wird aufgrund seiner Absorption bei 334, 340 oder 365 nm bestimmt.
D-Fructose-Bestimmung:
Hexokinase katalysiert die Phosphorylierung von D-Fructose mit ATP zu D-Fructose-6-phosphat
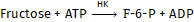
Nach Ablauf der Reaktion wird F-6-P durch Phosphoglucose-Isomerase (PGI) in G-6-P überführt:

G-6-P reagiert wiederum mit NADP unter Bildung von Gluconat-6-Phosphat und NADPH. Die zusätzlich gebildete NADPH-Menge ist der Fructosemenge äquivalent und wird aufgrund seiner Absorption bei 334, 340 oder 365 nm photometrisch bestimmt.
Enzymatische Inversion:
Saccharose wird durch das Enzym β-Fructosidase (Invertase) bei pH 4,6 zu Glucose und Fructose hydrolysiert:

Die D-Glucose-Bestimmung nach Inversion (Gesamt D-Glucose) erfolgt wie oben beschrieben.
Aus der Differenz der Glucose-Konzentration vor und nach enzymatischer Inversion wird der Gehalt an Saccharose berechnet.
Bestimmung der Saccharose mittels Enzymatik
Geeignet für Würze, Bier, Malzgetränke, Nährbier, Biermischgetränke, AFG, Säfte und Getränke
Saccharose ist als vergärbarer Zucker für die Technologie der Würze- und Bierbereitung von Bedeutung. Für die Beurteilung und Bewertung von Malzgetränken und Nährbieren spielt die Saccharose ebenfalls eine Rolle.
Der D-Glucosegehalt wird vor und nach enzymatischer Hydrolyse der Saccharose bestimmt.
Saccharose wird durch das Enzym β-Fructosidase (Invertase) bei pH 4,6 zu Glucose und Fructose hydrolysiert:

Glucose wird durch das Enzym Hexokinase (HK) und Adenosin-5’-triphosphat (ATP) zu Glucose-6-phosphat (G-6-P) phosphoryliert:

In Gegenwart des Enzymes Glucose-6-Phosphat-Dehydrogenase (G6P-DH) wird G-6-P von Nicotinamid-Adenin-Dinucleotidphosphat (NADP) zu Gluconat-6-phosphat oxidiert. Es entsteht reduziertes Nicotinamid-Adenin-Dinucleotidphosphat (NADPH):

Die während der Reaktion gebildete NADPH-Menge ist der Glucosemenge äquivalent. NADPH ist Messgröße und wird aufgrund seiner Absorption bei 334, 340 oder 365 nm bestimmt.
Aus der Differenz der Glucose-Konzentration vor und nach enzymatischer Inversion wird der Gehalt an Saccharose berechnet.
Bestimmung von Maltose und Maltotriosee, mittels Enzymatik
Geeignet für Würze, Bier, Malzgetränke, Nährbier, Biermischgetränke, AFG, Säfte und Getränke
Maltose ist Hauptbestandteil der Bierwürze bzw. des Würzeextraktes.
Maltose und Saccharose werden durch das Enzym α-Glucosidase (Maltase) bei pH 6,6 in zwei Moleküle D-Glucose bzw. in D-Glucose und D-Fructose gespalten:


Die gebildete D-Glucose wird durch das Enzym Hexokinase (HK) und Adenosin-5’-triphosphat (ATP) zu Glucose-6-phosphat (G-6-P) phosphoryliert:

In Gegenwart des Enzymes Glucose-6-Phosphat-Dehydrogenase (G6P-DH) wird G-6-P von Nicotinamid-Adenin-Dinucleotidphosphat (NADP) zu Gluconat-6-phosphat oxidiert. Es entsteht reduziertes Nicotinamid-Adenin-Dinucleotidphosphat (NADPH):

Die während der Reaktion gebildete NADPH-Menge ist der Glucosemenge äquivalent. NADPH ist Messgröße und wird aufgrund seiner Absorption bei 334, 340 oder 365 nm bestimmt.
Das Enzym α-Glucosidase ist gruppenspezifisch, d. h. die Spezifität ist auf die Art der glucosidischen Bindung gerichtet.
Es werden nur α-1,4-Bindungen, also neben Maltose auch Saccharose und Maltotriose, nicht jedoch Maltotetraose, unter den gegebenen Bedingungen gespalten. Bei der Maltoseberechnung muss deshalb der Saccharosegehalt berücksichtigt werden (Der Maltose-Ansatz erfasst die aus Maltose und Saccharose gebildete Glucose und die freie Glucose, der Saccharoseansatz erfasst die aus Saccharose gebildete Glucose und die freie Glucose).
Bestimmung der Konzentration an gelöstem Sauerstoff durch elektrochemische Sauerstoffsensoren mit membranbedeckten Elektroden
Die Bestimmung der Konzentration des Sauerstoffgehalts amperometrisch (Stromfluss) mittels Elektroden. Die Clark-Elektrode besteht aus Kathode und Anode, die über einen flüssigen Elektrolyten (KCI/KOH-Lösung) miteinander leitend verbunden sind. Dabei werden Edelmetalle wie Platin oder Gold für die Kathode gewählt und Silber für die Anode. Die gasdurchlässige Membran trennt das Elektrodenpaar von der Messlösung. Der Sauerstoff diffundiert durch die Membran in die Messzelle und wird an der Kathodenoberfläche unter Bildung von Hydroxidionen reduziert.
|
Reaktion an der Kathode: |
O2 + 4e– + 2 H2O |
→ 4 OH− |
|
Reaktion an der Anode: |
4 Ag+ + 4 Cl− |
→ 4 AgCI + 4e− |
Aus diesen chemischen Reaktionen resultiert ein Strom, der proportional zum Sauerstoffpartialdruck  ist. Die Sauerstoffelektrode verbraucht laufend Sauerstoff, der aus der Messlösung herausgelöst wird. Nach dem Gesetz von Henry kann unter Beachtung des Sauerstofflöslichkeitskoeffizienten im Medium die Sauerstoffkonzentration bestimmt werden [1].
ist. Die Sauerstoffelektrode verbraucht laufend Sauerstoff, der aus der Messlösung herausgelöst wird. Nach dem Gesetz von Henry kann unter Beachtung des Sauerstofflöslichkeitskoeffizienten im Medium die Sauerstoffkonzentration bestimmt werden [1].
Mittels des gemessenen Stroms und der Temperatur wird die Sauerstoffkonzentration berechnet.
Elektroden mit Schutzringelektrode zeichnen sich durch eine verkürzte Ansprechzeit aus (Hach Lange).
Elektroden mit saurem Elektrolyten (Hamilton) zeigen eine bessere Stabilität bei Messungen in karbonisierten Medien.