Bestimmung von D-Iso-Citronensäure mittels Enzymatik
Geeignet für alkoholfreie Getränke und Biermischgetränke
Fruchtsäfte
Die für bestimmte Fruchtarten typischen Säurespektren dienen neben anderen Kriterien als Beurteilungsgrundlage zum Erkennen unverfälschter Fruchtsäfte. Hierbei werden Weinsäure, Citronensäure und L-Äpfelsäure erfasst, die bis auf wenige Ausnahmen die Höhe der Gesamtsäure der Früchte bestimmen.
Citronensäure kommt als Hauptsäure in Buntsäften und Citrussäften vor. Orangensaft enthält in der Regel 3 – 17 g/l Citronensäure (AIJN).
In Citrussäften kann ein Zusatz von Citronensäure über das Verhältnis Citronensäure/D-Isocitronensäure nachgewiesen werden, da dieses in relativ engen Grenzen liegt. In Orangensaft werden Werte unter 130 gefunden.
D-Isocitronensäure liegt in Fruchterzeugnissen teilweise als Lacton vor, so dass das Lacton vor der enzymatischen Bestimmung verseift werden muss, um den Gesamt-D-Isocitronensäuregehalt zu erfassen.
Aus der Probe wird die D-Isocitronensäure durch Fällung als Bariumsalz isoliert und der D-Isocitronensäuregehalt enzymatisch bestimmt. Dabei wird D-Isocitronensäure durch Nicotinamid-Adenin-Dinucleotidphosphat (NADP) in Gegenwart des Enzyms Isocitrat-Dehydrogenase oxidativ zu α-Ketoglutarat decarboxyliert:

Die gebildete NADPH-Menge, zu messen an der Extinktionszunahme, ist der D-Isocitrat-Menge proportional.
Die Methode beschreibt die Beurteilung von Aromabeeinflussungen durch Kronenkorken und Aufreißverschlüsse. Die Produkte dürfen durch den Verschluss keine Geruchs- oder Geschmacksbeeinflussung erfahren.
Betriebe der Getränkeindustrie, die die abgefüllten Gebinde mit Kronenkorken oder Aufreißverschlüssen versehen.
Mit Mineralwasser befüllte und mit den zu prüfenden Kronenkorken oder Aufreißverschlüssen versehene Flaschen werden einer Behandlung im Lichtschrank unterzogen. Anschließend erfolgt die Verkostung der vorbehandelten Proben gegen eine Nullprobe.
Bestimmung von D-Gluconsäure mittels Enzymatik
Geeignet für alkoholfreie und alkoholische Getränke
Fruchtsäfte
Die positive Wirkung von Fermentationsgetränken auf den menschlichen Körper ist schon seit Jahrhunderten bekannt. So können die Kultgetränke Kwas (Russland) und Kombucha (Asien) auf eine lange Geschichte zurückblicken und wurden seit jeher als heilendes Getränk konsumiert. Bei der alkoholfreien Fermentation werden Mikroorganismen wie z. B. Milch- und Essigsäurebakterien verwendet. Dabei entstehen organische Säuren wie Milchsäure oder Gluconsäure, die die Verdauung und den Stoffwechsel fördern. Insbesondere aufgrund ihres leicht säuerlichen Geschmacks sind Fermentationsgetränke bei den Verbrauchern als gesunde natürliche Erfrischung beliebt.
Als Basis für Fermentationsgetränke dienen Malz, Fruchtsaft und Tee.
In der Regel enthalten Fermentationsgetränke 0,5 – 15 g/l D-Gluconsäure.
Die D-Gluconsäure wird durch Adenosin-5’-Triphosphat (ATP) in Anwesenheit von Gluconat-Kinase zu Gluconat-6-phosphat phosphoryliert
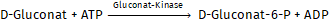
Das gebildete Gluconat-6-Phosphat wird durch Nicotinamid-Adenin- Dinucleotidphosphat (NADP) in Anwesenheit von 6-Phosphogluconat-Dehydrogenase (6-PGDH) zu Ribulose-5-Phosphat oxidiert.

Die im Verlauf dieser Reaktion gebildete Menge NADPH ist der D-Gluconsäuremenge proportional.
Bestimmung von Oxalsäure mittels Enzymatik
Geeignet für Malz, Würze, Biere, Biermischgetränke und alkoholfreie Getränke
Oxalsäure stammt vorwiegend aus dem verwendeten Malz. Durch Umsetzung mit den Calciumionen des Brauwassers können Trübungen von Calciumoxalat entstehen. Ebenso sind diese Kristalle Kondensationskeime für das spontane Entbinden von Kohlensäure (Gushing). Die exakte Bestimmung von Oxalsäure ist deshalb für die Brauereitechnologie von großer Bedeutung.
Oxalsäure (Oxalat) wird in der durch das Enzym Oxalatoxidase zu Kohlendioxid und Wasserstoffperoxid oxidiert.

In Gegenwart des Enzyms Peroxisase (POD) reagiert Wasserstoffperoxid mit MTBH (3-Methyl-2-Benzo-Thiazolinon-Hydrazon) und DMAB (3-Dimethyl-Amino-Benzoesäure zu einem blauen Quinon-Komplex.

Die Intensität der Farbe ist proportional zur Konzentration des Oxalats in der Probe und wird bei 590 nm gemessen.
Die Methode beschreibt die Bestimmung von organischen Säuren in Würze bzw. Kongresswürze mittels Kationenaustauscher.
Anwendbar bei allen (Labor)-Würzen.
Mit Hilfe eines Kationenaustauschers auf der Basis eines sulfonierten, quervernetzten Styrol/Divinylbenzol-Copolymers können verschiedene organische Säuren in Würze bestimmt werden. Der Trennmechanismus basiert wegen der hohen Ligandendichte auf einer Kombination aus Ionenausschluss, Ligandenausschluss und sterischem Ausschluss; die Detektion erfolgt über einen UV-Detektor.